東京医科大学の研究者の申請
医学倫理審査委員会の審査の対象となる研究
人を対象とする医学系研究に関する倫理指針等に基づき行う全ての研究
- 【審査の対象とならない研究】
- 臨床研究法および再生医療等の安全性の確保等に関する法律における臨床研究は、本学あるいは他の認定審査委員会による審議を受けることになります
申請に際しての資格
【東京医科大学の研究者の主な資格】
- 東京医科大学の研究者
- 必ず年度内に1回以上、研究倫理講習会を受講している
- 大学の定めるeAPRINの必須単元を受講している
【2024年度コンプライアンス・研究倫理教育コース(研究者⽤・9単元)】
(eAPRINに関しては研究支援課( kenkyu-s@tokyo-med.ac.jp )にお問い合わせください)
東京医科大学ホームページ(コンプライアンス教育・研究倫理教育)
eAPRINログインページ
11 研究者
| 11.1 | 研究者は大学が定める研究倫理教育を受講し修了する |
|---|---|
| 11.2 | 研究者は本学において行われる研究倫理に関する研修会を年度内に1回以上受講する 本学の研修会に参加が出来ず外部の研修を受講した場合には、受講証を事務局に提出する |
| 11.3 | 研究者は利益相反について定期自己申告を行うだけでなく、実施しようとする研究に係る利益相反に関する状況について、その状況を研究責任者に報告し、透明性を確保するよう適切に対応する |
(東京医科大学医学倫理審査委員会運用手順 第11項)
12 研究責任者
| 12.1 | 研究責任者となるものは、臨床研究法では必須とされる臨床研究中核病院が実施する臨床研究に従事する者を対象とした研修(臨床研究・治験従事者研修等)及びそれに準じた内容の研修を受講することが望ましい |
|---|---|
| 12.2 | 明らかな侵襲を伴う介入研究の研究責任者は、助教以上の教員でなければならない |
| 12.3 | 研修医はいかなる研究においても研究責任者となることはできない |
(東京医科大学医学倫理審査委員会運用手順 第12項)
申請の準備
医学倫理審査委員会に提出する書類の準備
東京医科大学のみの単独研究
- 研究計画書
- 説明文書(必要に応じて)
- 同意書(必要に応じて)
- 公示文書(必要に応じて)
- その他、医学倫理審査委員会が求める書類
- 単施設での既存のカルテ情報を用いた後ろ向きの観察研究を行う場合は専用のひな形を使用してください(このひな形を用いた場合は審査前レビューを行いません)
※各様式はこちら(学内専用)からご利用ください
他の施設を主たる研究機関とし東京医科大学が参加する多施設共同研究
- 主たる研究機関で承認された研究計画書
- 説明文書(必要に応じて)
- 同意書(必要に応じて)
- 公示文書(必要に応じて)
- 主たる研究機関で承認された結果通知書
- 研究計画書(別紙)
※本学で研究を実施するにあたり主たる研究機関で承認された研究計画書に記載された内容と異なる点、追記が必要な点を補記するための様式です
※研究計画書(別紙)の様式はこちら(学内専用)からご利用ください - その他、医学倫理審査委員会が求める書類
申請
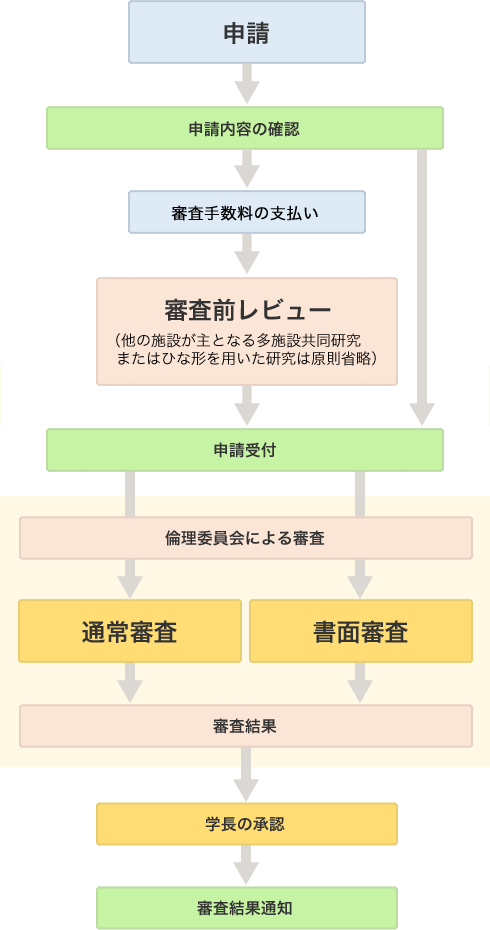
STEP 01 申請
準備が整ったら倫理審査申請システムから申請を行います
申請を受けて事務局が添付資料の不足等がないか確認します
外部施設の方については、本学との契約締結や倫理審査申請システムの登録の必要がありますので、
最初に研究推進センター(IRB@tokyo-med.ac.jp)までご連絡ください
STEP 02 審査手数料の支払い
医学倫理審査委員会事務局より審査手数料の請求が行われますので、支払いを行ってください
審査手数料はこちら
STEP 03 審査前レビュー
下記のような場合には、審査前レビューが行われます
- 東京医科大学の研究者が申請を行う研究の初回申請(他の施設を主たる研究機関とし東京医科大学が参加する多施設共同研究、既存のカルテ情報を用いた後ろ向き研究用のひな形を使用している場合は原則省略する)
- 軽微ではない変更の申請
- その他、倫理審査委員および事務局が必要と考えるもの
審査前レビューは提出された資料の内容が倫理審査委員会で科学的・倫理的な審査を的確に行うことができるようなものにするため、項目の過不足や未記入などを指摘し、予め書類の整備を行うプロセスです
審査前レビューで指摘された書類の整備が終わった後に、はじめて申請の受付が行われます
STEP 04 委員会への申請受付
医学倫理審査委員会への申請を受け付けて審査に進みます
STEP 05 審査
研究の内容によって通常審査もしくは書面審査で審査が行われます
- 【通常審査】
- 医学倫理審査委員会に出席していただき対面審査を行います
- 【書面審査】
- 下記の書面審査の対象となる研究については、委員長の判断によりオンラインあるいはメールによる審査を行います(審査の経過によって、通常審査が必要となる場合があります)
書面審査の対象
- ■他の研究機関と共同して実施される研究であって、既に当該研究の全体について共同研究機関において委員会の審査を受け、その実施について適当である旨の意見を得ている場合の審査
- ■研究計画書の軽微な変更に関する審査
- ■侵襲を伴わない研究であって介入を行わないものに関する審査
- ■軽微な侵襲を伴う研究であって介入を行わないものに関する審査
- ■提供者及び代諾者等に対して最小限の危険を超える危険を含まない研究の審査
- ■その他これらに準ずる研究や変更であって、書面審査を必要とするもの
STEP 06 結果の通知
倫理審査申請システムを通して審査結果が通知されます
STEP 07 研究の開始
承認の結果の通知を受け取ったら研究を開始することが出来ます
外部施設からの申請
外部施設の方は、本学との契約の締結等が必要となりますので、まずは下記までメールにてご連絡ください
東京医科大学研究推進センター
医学倫理審査委員会事務局
<連絡先>
メールアドレス:IRB@tokyo-med.ac.jp
倫理審査委員会の審査手数料(外部からの申請)
初回審査手数料 100,000円