研究実施中
報告
- ・定期報告
- ・有害事象報告
- ・終了・中止報告
※終了報告の際は総括報告書もしくは学会発表の際の抄録や論文成果等も提出してください
※有害事象報告と総括報告書の様式はこちら(学内専用)からご利用ください
各種報告は倫理審査申請システムより行ってください
計画の変更
変更申請の準備
医学倫理審査委員会に提出する書類の準備
- 新旧対照表
- 変更内容が反映された研究計画書等の書類
- その他、医学倫理審査委員会が求める書類
申請
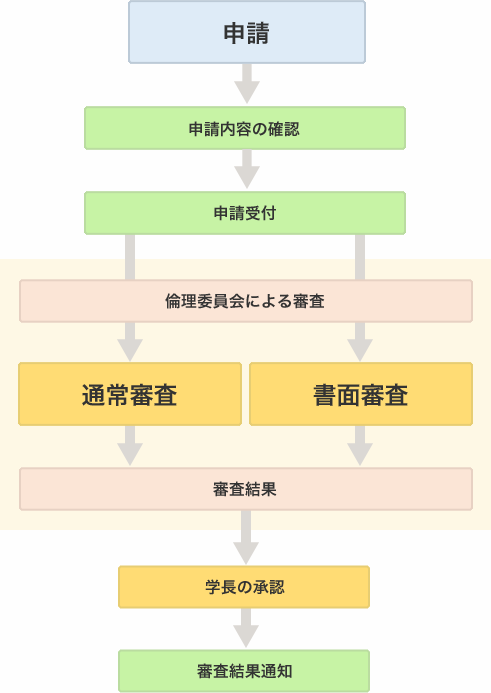
STEP 01 申請
STEP 02 申請受付
申請を受けた事務局が添付資料の不足等がないか確認し、変更申請を受け付けます
STEP 03 審査
書面審査により審査が行われます
- 書面審査の対象となる研究については、委員長の判断によりオンラインあるいはメールによる審査を行います(変更内容によって、通常審査が必要となる場合があります)
STEP 04 結果の通知
倫理審査申請システムを通して審査結果が通知されます
STEP 05 研究の開始
承認の結果通知を受け取ったら、変更された研究計画に基づき研究を開始することが出来ます